|
Biologia- nauka o życiu
|
|
| Strona Główna | | Kontakt | Ekipa | |
|
| Budowa białek | Podział białek | Role białek w organizmie | Właściwości białek | |
|
Właściwości chemiczne białek Amfoteryczność
Amfoteryczny charakter białek jest wynikiem obecności i rozmieszczenia kwasowych i zasadowych grup łańcuchów bocznych, ponieważ w długim łańcuchu polipeptydowym końcowe grupy aminowa i karboksylowa, odwrotnie niż w przypadku aminokwasów, mają mały udział w tworzeniu dipolarnego charakteru cząsteczki. 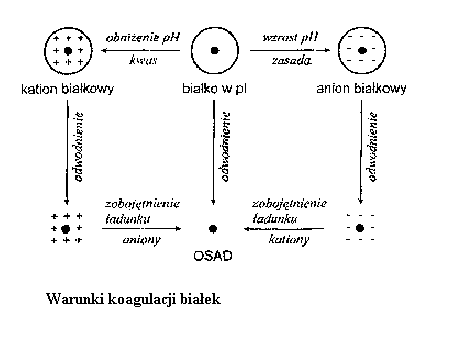
W stabilizacji pH krwi dużą rolę odgrywa hemoglobina. Normalna wartość pH krwi wynosi 7,35 - 7,40. Obniżenie go o 0,5 pH zagraża życiu. Wysalanie Niewielkie stężenie soli w nieorganicznych zwiększa rozpuszczalność białek. Jeżeli jednak stężenie soli będzie wzrastać, korzystny wpływ jonów soli na rozpuszczalność białka ustaje, a przy dużym stężeniu soli białka rozpuszczalne w wodzie będą się wytrącać z roztworów wodnych. Proces ten nazywa się wysalaniem. 
Hydroliza
Hydroliza białek polega na depolimeryzacji białek na poszczególne aminokwasy. Hydrolizę białek można przeprowadzać na trzy sposoby: pod wpływem kwasu, zasady lub enzymu. Denaturacja
Denaturacją białka nazywamy takie przeprowadzenie metodami fizycznymi lub chemicznymi, zmian w strukturze białka, które prowadza do mniejszej lub większej utraty aktywności biologicznej białka, przy czym jego struktura pierwszorzędowa nie zostaje zmieniona. Podczas denaturacji w dużej mierze zniszczeniu ulegają wiązania wodorowe, a w obecności odczynników redukcyjnych rozszczepieniu ulegają wiązania disiarkowego. Często denaturacja jest odwracalna i po usunięciu czynnika denaturującego białko wraca do pierwotnej postaci. Proces ten nazywa się renaturacją. Renaturacja jest też możliwa w przypadku denaturacji redukcyjnej, ale wiele przypadków denaturacji jest nieodwracalnych. Fizycznymi metodami denaturacji białek są: Silne mieszanie, ogrzewanie, naświetlanie promieniami UV, rentgenowskimi i ? lub działanie ultradźwiękami.
Denaturacja chemiczna zachodzi pod wpływem takich związków jak: Reakcje charakterystyczne
Białka ulegają różnym reakcjom charakterystycznym determinowanym przez właściwości chemiczne reszt aminokwasowych. Reakcja biuretowa wykrywa obecność wiązania peptydowego w białku. Reakcja ksantoproteinowa służy wykryciu obecności związków aromatycznych w podstawniku tyrozyny i fenyloalaniny. Reakcja Millona też służy wykryciu związków aromatycznych w podstawniku tyrozyny, a reakcja Pauly`ego ma takie samo zadanie tylko w tyrozynie i tryptofanie. Wszystkie te reakcje są reakcjami barwnymi. Reakcja biuretowa Reakcja ta polega na tworzeni się związku kompleksowego pomiędzy jonem miedzi z rozcieńczonego roztworu siarczanu VI miedzi, a wiązaniem peptydowym w białku w środowisku zasadowym. Powstały kompleks przybiera barwę fioletową. 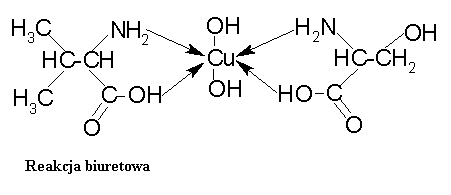
Reakcja ksantoproteinowa Jest to reakcja stężonego kwasu azotowego V na białko. W wyniku tej reakcji związki aromatyczne będące podstawnikami aminokwasów ulegają reakcji nitrowania. Białko przyjmuje żółty kolor związków nitrowych. Produkt reakcji przeprowadzanej w środowisku alkalicznym ma kolor pomarańczowy. 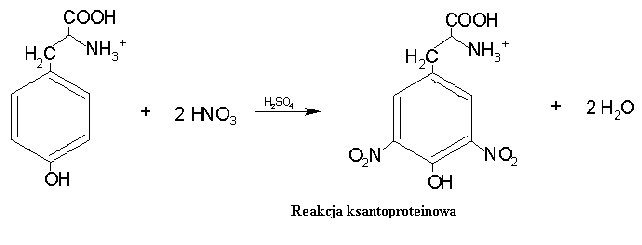
|